HTLV
Vírus Linfotrópico de Células T Humana
O que é HTLV?
O vírus HTLV (sigla da língua inglesa que indica vírus que infecta células T humanas) é um retrovírus isolado em 1980 a partir de um paciente com um tipo raro de leucemia de células T. Apresenta dois tipos: O HTLV-1 que está implicado em doença neurológica e leucemia, e o tipo 2 (HTLV-2) que está pouco evidenciado como causa de doença.
Histórico e Epidemiologia
O foco do presente estudo é o HTLV-1, que foi o primeiro retrovírus humano oncogênico causador de doença infecciosa (1). Pouco tempo depois, outro subtipo de HTLV, o HTLV-2, foi descrito em um tipo diferente de leucemia de células T (2), cujo papel na oncogênese continua a ser estabelecido (3). Mais recentemente, infecções com dois outros vírus relacionados, HTLV-3 e HTLV-4, foram relatados em alguns indivíduos na África Subsaariana, aparentemente, resultado de infecção zoonótica de primatas locais (4). A detecção da infecção pelo HTLV só foi possível a partir de 1983, quando foram introduzidos testes sorológicos para a avaliação da disseminação viral (5). No Brasil, estes testes foram introduzidos a partir de 1993 em todos os bancos de sangue (6).
Estima-se que de 10 a 20 milhões de pessoas em todo o mundo estejam infectadas pelo HTLV-1 (7-9), todavia, a maioria delas permanece assintomática. Apesar da infecção pelo HTLV-1 ocorrer em diversas partes do mundo, sua prevalência varia de acordo com a localização geográfica, fatores étnicos e raciais ou, ainda, em grupos populacionais mais expostos aos fatores de risco como observado na Bahia (10).
Diagnóstico
O Diagnóstico de HTLV é feito através de exames específicos de sangue que são realizados em bancos de sangue ou através da solicitação de um médico..
Testes laboratoriais para o diagnóstico da infecção pelo HTLV-1 e HTLV-2
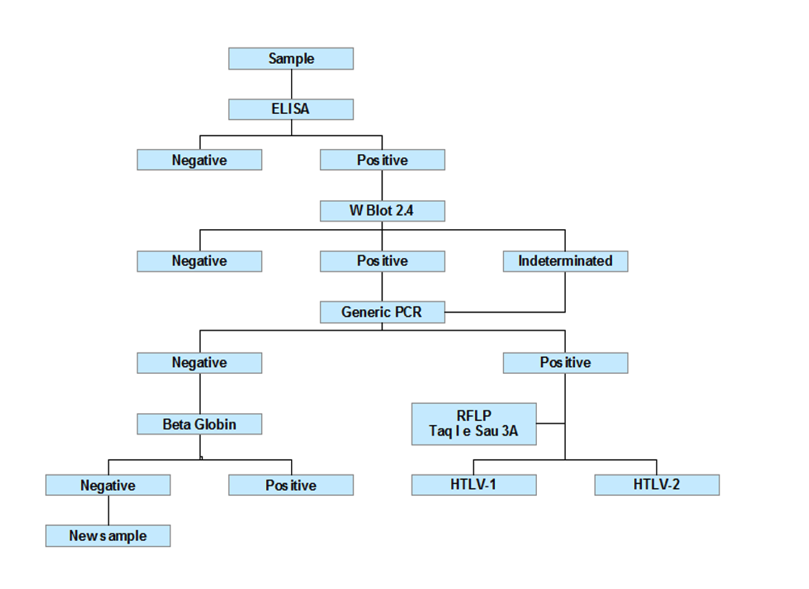
A primeira etapa do diagnóstico é realizada através da triagem de anticorpos anti-HTLV usando dois testes imunoenzimáticos autorizados, de fabricantes diferentes, preparados com antígenos do HTLV-1 a partir do lisado total do vírus e algumas proteínas recombinantes. Inicialmente, as amostras reagentes são testadas em duplicata para minimizar a possibilidade da reatividade ser devida a erro técnico. Espécimes que são reagentes em qualquer um dos testes duplicados são consideradas reagentes repetidamente. Espécimes que não reagem em qualquer um dos testes repetidos em duplicatas são considerados não reagentes Caso a amostra seja positiva, realiza-se o teste de “immunoblot” (WB) . Os critérios seguintes, para soropositividade de HTLV-1/2, são: um espécime, que é reagente repetidamente por ELISA para HTLV-1/2, tem que demonstrar imunoreatividade à proteína p24 e para um produto de gene env (gp61/68 e/ou de gp46). São considerados indeterminados os que não satisfazem estes critérios mas mostram imunoreatividade a pelo menos um produto. Para confirmação do resultado reagente e/ou para elucidar casos de resultados indeterminados, recomenda-se a realização do teste de PCR para HTLV, que será positivo caso encontre a presença da sequência viral no DNA do portador. Este teste possibilita a diferenciação do subtipo viral (HTLV-1 ou 2).
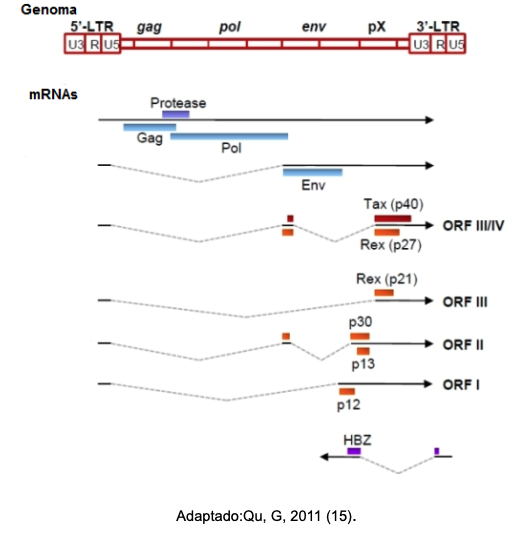
Estrutura Viral
O HTLV-1 é um retrovírus pertencente à família Retroviridae, e subfamília Orthoretrovirinae, subfamílias formada por vírus que contêm no seu genoma oncogenes, que são sequências de ácidos nucleicos que geram produtos capazes de induzir o aparecimento de neoplasias em animais e humanos (11). A morfologia do HTLV-1 é semelhante aos demais retrovírus, porém, além das regiões comuns aos retrovírus, possui uma região adicional chamada pX, responsável por codificar as proteínas regulatórias Tax , Rex, HBZ e as proteínas acessórias p12, p13 e p30, importantes para a infectividade viral, proliferação e imortalização das células e, ainda, podem ter influência sobre a patogênese (12-14) (Figura 2).
Histórico Natural da Doença
Apesar do HTLV-1 ter baixa morbidade, alguns indivíduos podem apresentar formas mais atenuadas ou incompletas da HAM/TSP (16). A HAM/TSP é definida como uma doença crônica que provoca a desmielinização progressiva na medula espinal, usualmente de início insidioso, que acomete de 1 a 2% dos portadores de HTLV-1. Está associada a um grau variável de disfunções esfincterianas e sensitivas, que afeta mais mulheres do que homens, geralmente na quarta e na quinta década de vida (17, 18). Estima-se que dez (exatamente 0,96%) de 1000 pacientes podem desenvolver HAM/TSP, após décadas de infecção e com idade de, aproximadamente, 43 anos (1, 19). Muitos fatores têm sido estudados até momento, mas nenhum de fato se mostrou adequado para predizer esse desenvolvimento.
Deste modo, a interação entre vírus e hospedeiro é objeto de várias discussões nas últimas décadas, destacando-se fatores imunológicos do hospedeiro como principais desencadeadores no processo imunopatológico para HAM/TSP (20). Porém, os eventos imunológicos promovidos pelo HTLV-1 não estão bem esclarecidos. Acredita-se que a resposta celular desencadeada pelas células T CD8+ possa ser crucial para a progressão à HAM/TSP (21, 22).
A HAM/TSP é potencialmente considerada uma doença imune mediada, principalmente devido ao aumento de citocinas e quimiocinas, em que se destaca pela elevação dos níveis de IFN-γ (23). Com isso, o acúmulo desses elementos na barreira hematocefálica induz danos na bainha de mielina, inicialmente uma leve inflamação e, ao longo dos anos, proporciona lesões irreversíveis, incluindo-se alterações mais sutis em torno de 30% dos indivíduos considerados inicialmente como assintomáticos (16).
A terapia com corticosteróides, preconizada por alguns grupos, tem sido utilizada para amenizar os sintomas da mielopatia, especialmente entre os pacientes em estágio inicial de doença, quando a inflamação é mais proeminente (9). Um dos possíveis mecanismos da terapia com corticosteróides é a diminuição da ativação celular, em especial as células T CD8+, que podem levar ao declínio da carga proviral de HTLV-1 (24).
Interação Vírus + Hospedeiro
Pouco se sabe a razão da evolução do estágio assintomático para HAM/TSP. Apesar dos vários estudos mostrando a importância da resposta imune, o perfil genético do portador do HTLV-1 pode ter muito relevância. Por exemplo, indivíduos com HLA (antígeno leucocitário humano) classe I tem maior susceptibilidade de evoluir para a doença que outros tipos de HLA (25), assim como citocinas inflamatórias como o IFN lambda, interlucina 15 (IL-15) e fator de necrose tumoral (TNF-α) (12).
Além da possibilidade do polimorfismo de citocinas, outros fatores genéticos podem estar implicados na patogênese da mielopatia. Entre vários genes que poderiam estar relacionados, destaca-se o HLA e os receptores do tipo imunoglobulina de células Natural Killer (KIR). Esses genes possuem loci altamente polimórficos, que interagem entre si, porém seus SNPs e principais variantes ainda não foram identificados. Moléculas de HLA-C, ligantes para receptores KIR2DL, possuem um dimorfismo funcional relevante para determinar a especificidade KIR. Como exemplo, cita-se o grupo de alelos do HLA-C 1 (HLA-C1), identificado por Ser77/Asp80 de domínio alfa 1, que são ligantes para os inibidores de KIR2DL2 e KIR2DL3 e a ativação de KIR2DS2 (10). Enquanto, os alelos do HLA-C grupo 2 (HLA-C2), identificados por Asp77/Lys80, são reconhecidos pelo KIR2DL1 tendo ação inibitória e ativando KIR2DS1(9). Por sua vez, o KIR2DL3 e o seu ligante, HLA-C1 tem sido associado com um aumento da probabilidade de resposta virológica sustentada ao tratamento do HCV induzida pelo tratamento com interferon peguilado alfa e ribavirina (13, 14, 26, 27). Essa associação pode ser atribuída à diferença de células Natural Killer (NK) e a ativação da função celular no contexto da mesma interação KIR/HLA (4, 28).
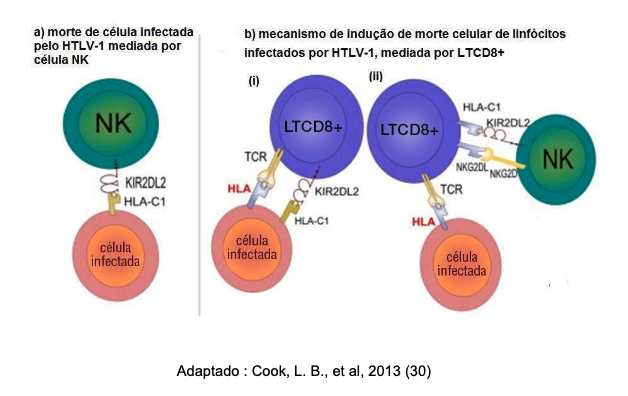
Deste modo, um modelo do mecanismo de inibição do KIR associado ao HLA foi proposto, atribuindo-se a associação típicas entre KIR-HLA, ativando-se diretamente as células NK (4), demonstrado na figura 3.
Entretanto, outro estudo observou que o KIR2DL2 não tem impacto sobre a carga proviral ou a HAM/TSP (5), porém o efeito protetor de peptídeos de HBZ poderia estar envolvido nessa interação (figura 3 a). Por ouro lado, existe uma associação entre os receptores inibitórios de KIR e os LTCD8+, desencadeando uma redução de ativação morte celular e proteção por exaustão (figura 3 a(i)), outra hipótese seria que os receptores inibitórios de KIR poderiam atuar sobre as células reduzindo a morte de células NK ativadas (figura 3 b (ii)) (29).
Entre outros fatores genéticos, os mais bem estudados têm sido os haplótipos dos antígenos leucocitários humanos (HLA) classe 1 (HLA-A, HLA-B, HLA-C) do complexo maior de histocompatibilidade (MHC), que codificam para glicoproteínas expressas na superfície de quase todas as células nucleadas, e cuja maior função é a apresentação de peptídeos antigênicos a linfócitos TCD8. A eficácia da resposta imune específica para HTLV-1, especialmente a resposta de linfócitos T citóxicos (CTL) CD8+, tem sido demonstrada como sendo a chave para controlar a carga proviral do HTLV-1 (31). A evidência mais convincente de um papel protetor de CTLs do hospedeiro surgiu da observação, em uma população no sul do Japão, de que a presença de um dos dois genes HLA de classe 1, HLA-A*02 ou HLA-Cw*08, esteve associada com uma carga proviral mais baixa e menor prevalência de HAM/TSP (25, 32).
Alguns alelos HLA específicos têm sido associados à proteção, enquanto outros foram correlacionados com risco aumentado de desenvolvimento de HAM/TSP. Os genes das moléculas MHC Classe 2 (HLA-DR, HLA-DP, e HLA-DQ) codificam para glicoproteínas expressas em células apresentadoras de antígenos profissionais (APCs), sendo sua principal função a apresentação de peptídeos antigênicos aos linfócitos TCD4+ (auxiliares).
Vale ressaltar que podem ocorrer diferenças na frequência de alelos HLA em diferentes populações e variações no efeito protetor de certos alelos HLA de acordo com a etnia (Tabela 1).
Tabela 1 – Distribuição dos níveis de susceptibilidade/proteção para HAM/TSP associados aos alelos HLA.
| Alelos HLA | Japoneses | Brasileiros | Iranianos | Espanhóis | Afro- Caribenhos (Martinica) | Afro-Caribenhos (Londres) | Jamaicanos |
|---|---|---|---|---|---|---|---|
| A*02 | *** | ** | — | — | — | *** | — |
| Cw*08 | *** | — | — | — | |||
| A*24 | ↓↓ | — | — | ||||
| B*07 | ↓↓ | ↓ | — | ↓↓ | — | — | |
| B*5401 | ↓↓ | ᴓ | ᴓ | ᴓ | ᴓ | ᴓ | ᴓ |
| DRB1*0101 | ↓ | — | ↓ | ↓↓ | — | — | |
| DRB1*11 | ↓↓ | ↓↓ | ↓↓ | ↓↓ | — | — | |
O resultado de efeito protetor para HLA-A*02 na HAM/TSP visto em japoneses foi relatado em uma pequena amostra de 29 indivíduos de Londres, dos quais 27 eram de origem caribenha e dois caucasianos (27), todavia, no Brasil também observado (33, 34). Por lado, em outras populações, tais como indivíduos afro-caribenhos oriundos da Martinica (35), jamaicanos (36), espanhóis (16) ou iranianos (37, 38) não foram encontradas associações.
Ao contrário da expressão de HLA-A*02 e HLA-Cw*08, que estava associada a um efeito protetor, observou-se que HLA-DRB1*0101 e HLA-B*5401 apresentavam associação com um aumento na susceptibilidade para HAM/TSP (25, 39). Para o HLA-DRB1*0101, no entanto, a associação com a susceptibilidade à doença torna-se evidente na ausência do efeito protetor de HLA-A*02 (40), enquanto HLA-B*5401 esteve independentemente associado à susceptibilidade para a doença e, entre indivíduos com HAM/TSP, foi associado com um aumento significativo na carga proviral (21). HLA-22, HLA-Cw82 e HLA-DR1 também estiveram, em população no sul do Japão, associados a risco mais elevado para HAM/TSP (41). No Irã, além de HLA-A*02, também HLA-Cw*08 e HLA-A*24 não estiveram associados a menor risco de HAM/TSP ou carga proviral mais baixa (16, 42).
No Brasil, HLA-Cw*08 não apresentou efeito protetor e HLA-B*07 apresentou susceptibilidade para HAM/TSP apenas em pacientes negativos para HLA-A*02 (43). Em outros países, como a Espanha, não foi encontrada associação entre a presença de alelos protetores (HLA-A*02 e/ou HLA-Cw08) e HAM/TSP ou diferenças significativas na carga proviral do HTLV-1 quando comparados indivíduos com ou sem estes alelos; no entanto, HAM/TSP foi significativamente associada HLA-B*07 e HLA-DRB1*0101 (44). O alelo HLA-B*5401 não foi encontrado nas populações destes países (Tabela 1), pois é visto quase exclusivamente em indivíduos do leste asiático (25).
Entre os alelos associados a risco, o HLA-DRB1*0101 também esteve associado com susceptibilidade para HAM/TSP na população do Irã e, assim como entre os japoneses, esse efeito foi observado apenas em indivíduos HLA-A*02 negativos, não ocorrendo em indivíduos HLA-A*02-positivos (45). A associação de HLA-DR*11 com HAM/TSP, previamente descrita em pacientes japoneses, foi observada no Brasil apenas (46) além do HLA-Cw*07 correlacionado a HAM/TSP somente na ausência de HLA-A*02 (46).
Vale ressaltar que a resposta imune parece ser um fator crucial na patogênese da HAM/TSP. Por exemplo, o estudo mostrou que os pacientes com HAM/TSP apresentaram maiores níveis de IFN-gama em comparação com pacientes assintomáticos (47). Além disso, o perfil do polimorfismo no SNP rs12979860 do cromossomo 19 induz a produção de IFN-lamba 3, e uma resposta imune a infecção por HTLV-1, levando a um dano neuronal na medula espinhal (1, 48).
Além de características genéticas, como alguns haplótipos de HLA, descritas anteriormente como envolvidas na patogênese da HAM/TSP (25), fatores pró-inflamatórios (49) desempenham importante papel nessa patogênse. Neste sentido, os polimorfismos na IFN-λ4 são influenciados pela ascendência genética. Da mesma forma, entre os pacientes crônicos do HCV, aqueles que carregavam o alelo mutado em homozigoze G no rs8099917 do cromossomo 19, tiveram menor expressão de RNA mensageiro de IFN-λ4 nas células mononucleares (20).
Como foi relatado recentemente, genes estimulados por interferons, provavelmente regulam a expressão de citocinas que pode ser diferente no tecido infectado e, ainda, entre os tipos de células dentro do fígado e da medula espinal (50). Sabe-se que o IFN-λ4 atenua a produção da IL-13; e é também possível que a citocina produzida em pessoas com o alelo de proteção diminua a expressão desta, que leva a um efeito semelhante ao protetor e menores interações entre inibitórios KIR e HLA-C (51). Assim, a IFN-λ4 e outros três interferons tais como IL28A ou IL-29 ativam a cascata antiviral via JAK-STAT que é semelhante e provavelmente sinérgica aos interferons do tipo 1 (como o interferon alfa), embora utilize distintos receptores, contribuindo para patogênese da HAM/TSP.
Supõe-se que os polimorfismos nos genes da IFN-λ4, KIR e HLA-C, possam desencadear uma cascata antiviral por meio da via JAK-STAT. Desse modo pode desempenhar um papel importante no desenvolvimento da HAM/TSP, devido, à sua semelhança com outras doenças imunomediadas como, por exemplo, a Hepatite C (50). Em estudo anterior, demonstrou-se que existe uma associação entre um polimorfismo da IFN-λ4 (na posição rs8099917 do cromossomo 19), especificamente no alelo mutado em homozigoze GG, aumentando-se em sete vezes o risco de desenvolver HAM / TSP (15). Entretanto, ainda não está claro que esse polimorfismo, por si só, pode desencadear o desenvolvimento de HAM/TSP.
Alguns parâmetros, como elevada carga proviral de HTLV-1 (25), a constante linfoproliferação espontânea in vitro (52), aumento das células T CD8+ específicos e altos títulos de anticorpos anti-HTLV-1, tanto no soro quanto no liquor (52), parecem também associados com à presença da HAM/TSP (53, 54). Esses marcadores são utilizados por muitos pesquisadores para a avaliação da evolução clínica dos pacientes infectados ao longo do tempo. A princípio, acreditava-se que células T CD4+ do sangue periférico representavam o alvo primário para a infecção pelo HTLV-1. Atualmente, sabe-se que outras populações celulares também são susceptíveis à infecção pelo HTLV-1, como as células NK por exemplo (55).
Neste contexto, estas células proliferam espontaneamente e expressam várias citocinas pró-inflamatórias e moléculas de adesão que poderiam favorecer a migração direcionada dos linfócitos T CD4+ infectados, do sangue periférico para o sistema nervoso central (SNC) (56, 57). Outros fatores também podem estar contribuindo com a desmielinização da HAM/TSP, como a expressão viral, a desregulação da expressão de citocinas, a produção de anticorpos específicos anti-HTLV-1 e infiltração de linfócitos T CD8+ citotóxicos (CTL) e macrófagos ativados no SNC (58). Estudos prévios demonstraram uma correlação entre carga proviral de HTLV-1 e a frequência de linfócitos T CD8+, efetores e de memória específicos anti-Tax em pacientes com HAM/TSP. Esses dados sugeriram que a resposta mediada por CTLs Tax específicas estaria ligada diretamente aos níveis de carga proviral (59).
As células T CD8+ apresentam reservatório celular adicional para o HTLV-1 “in vivo”. Além disso, por meio da citometria de fluxo, mostrou-se que os linfócitos T CD8+ são células que, predominantemente, se expandem durante a estimulação espontânea in vitro (25). Isso sugere que a resposta mediada pelas CTLs específicas não seria o único evento responsável pela alta carga proviral, sendo que a expansão celular poderia ser um fator importante na contribuição da elevação da carga proviral no sangue periférico e no SNC durante a doença neurológica.
Em um modelo proposto, o evento inicial da progressão da HAM/TSP teria a participação de citocinas pró-inflamatórias, tais como IL-1b, IL-6, INF-γ, TNF-α, e IL-15. Essas citocinas produzidas por células T, macrófagos e microglias ativadas, seriam de grande importância na desmielinização neuronal (52). Assim, embora a maioria dos trabalhos sugira que o estabelecimento de um padrão de resposta imune citotóxica esteja associado ao desenvolvimento da HAM/TSP, outros autores sugerem que mecanismos inerentes à imunidade humoral também podem estar na patogênese da HAM/TSP (52). Deste modo, a ativação persistente de elementos da resposta imune, tais como a estimulação de linfócitos T CD4+ e T CD8+, a expressão de moléculas de adesão e receptores na superfície de linfócitos, monócitos e a produção de fatores solúveis como citocinas e quimiocinas, favorecem a migração direcionada de células infectadas ou não para o sistema nervoso central (52).
Apesar da complexidade, o entendimento das interações hospedeiro versus HTLV-1 é de fundamental importância para avaliar prognóstico clínico dos portadores assintomáticos, visto que as atuais opções de diagnósticos e tratamento não são adequadas, até o momento, para determinar o risco de progressão para HAM/TSP (60).
Principais Informações
O vírus HTLV (sigla da língua inglesa que indica vírus que infecta células T humanas) é um retrovírus isolado em 1980 a partir de um paciente com um tipo raro de leucemia de células T. Apresenta dois tipos: O HTLV-1 que está implicado em doença neurológica e leucemia, e o tipo 2 (HTLV-2) que está pouco evidenciado como causa de doença.
Não. A minoria dos portadores assintomáticos (sem sintomas) poderão desenvolver alguma doença. No Japão, por exemplo, 14 em cada 1500 portadores assintomáticos poderão desenvolver a doença neurológica (dificuldade de andar). No caso de leucemia o risco é ainda menor, ou seja, um em cada 10.000 portadores poderá desenvolve-la ao longo da vida.
Como já enfatizamos, cerca de 99% das pessoas portadoras do HTLV-1 NUNCA desenvolverão qualquer problema de saúde relacionado ao vírus HTLV. Entretanto, alguns pacientes podem desenvolver problemas neurológicos, geralmente, começam a se queixar de dores nos membros inferiores (panturrilhas), na região lombar (parte inferior da coluna lombar), dificuldade de defecção ou micção. Estes sintomas são sempre progressivos e estão na região abaixo da linha do umbigo.
O HTLV possui as mesmas rotas de transmissão que outros vírus como vírus da imunodeficiência humana (HIV) e vírus da hepatite C (HCV): pela relação sexual desprotegida com uma pessoa infectada; uso em comum de seringas e agulhas durante a droga-adição; da mãe infectada para a o recém-nascido (principalmente pelo aleitamento materno).
Felizmente, desde 1993 todos os bancos de sangue do Brasil devem testar os doadores de sangue para o HTLV. Assim, o risco de transmissão, praticamente, não existe em nosso país, nos últimos 7 anos.
Existe a recomendação para uso de preservativo (camisinha) em todas as relações sexuais.
As chances de transmissão vertical são consideradas baixas (<10%) durante a gravidez. Entretanto, recomenda-se não amamentar no peito, pois o risco de transmissão pelo leite materno é razoável. Uma alternativa é o uso de leite vindo de bancos de leites, ou uso de fórmulas.
Sabendo os modos de transmissão, podemos indicar os grupos que mais poderiam estar expostos a este vírus: pessoas que utilizam (ou usaram) drogas endovenosas onde trocavam seringas ou agulhas, pessoas portadoras de HIV e pessoas que receberam transfusão de sangue antes de 1993.
Parece que algumas pessoas possuem uma predisposição genética para o desenvolvimento, porém isto ainda está em estudo.
Na primeira consulta, além da sorologia para HTLV-1/2, geralmente solicitamos sorologia para agentes que, potencialmente, apresentam rotas similares de transmissão como o vírus da hepatite B, vírus da hepatite C, HIV e sífilis. Em nosso Serviço de Ambulatório, os indivíduos portadores assintomáticos tem consulta a cada seis meses de intervalo. Os exames de sangue solicitados são: hemograma completo, contagem de linfócitos T CD4/CD8, cultura de linfócitos, protoparasitológico, Glicemia, DHL.
Até o momento nenhum exame tem esta capacidade. Entretanto, novos estudos indicam que a quantidade do vírus HTLV-1 no sangue, chamada carga viral, poderá indicar algum risco.
Como o risco do desenvolvimento da doença associado ao HTLV-1 é muito baixo, não existe indicação de tratamento nos casos assintomáticos, até este momento.
Os casos onde existem sintomas comprovados de doença associada ao HTLV-1, como paraparesia espástica tropical (TSP), uveíte, ATL, entre outras. O tratamento irá depender de uma avaliação neurológica, assim como estadiamento do grau de comprometimento, tempo de evolução, presença de outras infecções virais etc.
Somente por exame sorológico específico para pesquisa de anticorpos anti-HTLV-1/2 no sangue. Após os exames de triagem, geralmente utilizando teste de ELISA, existe uma necessidade, em caso deste teste ser reativo (positivo) da realização do teste para confirmar e diferenciar anticorpos anti-HTLV-1 e anti-HTLV-2.
Conheça nossas redes sociais
Referências
1. Thio CL, Thomas DL. Interleukin-28b: a key piece of the hepatitis C virus recovery puzzle. Gastroenterology. 2010;138(4):1240-3.
2. Thomas DL, Thio CL, Martin MP, Qi Y, Ge D, O’Huigin C, et al. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus. Nature. 2009;461(7265):798-801.
3. Balagopal A, Thomas DL, Thio CL. IL28B and the control of hepatitis C virus infection. Gastroenterology. 2010;139(6):1865-76.
4. Calattini S, Chevalier SA, Duprez R, Bassot S, Froment A, Mahieux R, et al. Discovery of a new human T-cell lymphotropic virus (HTLV-3) in Central Africa. Retrovirology. 2005;2:30.
5. Blattner WA, Saxinger CW, Gallo RC, Jr. HTLV-I, the prototype human retrovirus: epidemiologic features. Progress in clinical and biological research. 1985;182:223-43.
6. McLaren PJ, Coulonges C, Bartha I, Lenz TL, Deutsch AJ, Bashirova A, et al. Polymorphisms of large effect explain the majority of the host genetic contribution to variation of HIV-1 virus load. Proceedings of the National Academy of Sciences of the United States of America. 2015;112(47):14658-63.
7. Rallon NI, Restrepo C, Naggie S, Lopez M, Del Romero J, Goldstein D, et al. Interleukin-28B gene polymorphisms do not influence the susceptibility to HIV-infection or CD4 cell decline. Aids. 2011;25(2):269-71.
8. Parczewski M, Bander D, Leszczyszyn-Pynka M, Urbanska A, Socha L, Boron-Kaczmarska A. IL28B CC genotype is associated with higher all-cause mortality in antiretroviral-treated HIV-infected patients. AIDS Res Hum Retroviruses. 2012;28(12):1640-6.
9. Martin MP, Qi Y, Goedert JJ, Hussain SK, Kirk GD, Hoots WK, et al. IL28B polymorphism does not determine outcomes of hepatitis B virus or HIV infection. The Journal of infectious diseases. 2010;202(11):1749-53.
10. Stanzione M, Stornaiuolo G, Rizzo V, Pontarelli A, Gaeta GB. HBsAg seroconversion after pegylated interferon alfa 2a rescue in a lamivudine-resistant patient with HBeAg-negative chronic hepatitis B and favourable IL28-B genotype. Infez Med. 2016;24(2):144-6.
11. Tang S, Yue M, Wang J, Zhang Y, Yu R, Su J, et al. Associations of IFN-gamma rs2430561 T/A, IL28B rs12979860 C/T and ERalpha rs2077647 T/C polymorphisms with outcomes of hepatitis B virus infection: a meta-analysis. J Biomed Res. 2014;28(6):484-93.
12. Chen J, Wang W, Li X, Xu J. A meta-analysis of the association between IL28B polymorphisms and infection susceptibility of hepatitis B virus in Asian population. BMC Gastroenterol. 2015;15:58.
13. Tan SC, Ankathil R. Genetic susceptibility to cervical cancer: role of common polymorphisms in apoptosis-related genes. Tumour Biol. 2015;36(9):6633-44.
14. Vineretsky KA, Karagas MR, Kuriger-Laber JK, Waterboer T, Pawlita M, Nelson HH. HLA-C -35kb expression SNP is associated with differential control of beta-HPV infection in squamous cell carcinoma cases and controls. PloS one. 2014;9(8):e103710.
15. Assone T, de Souza FV, Gaester KO, Fonseca LA, Luiz Odo C, Malta F, et al. IL28B gene polymorphism SNP rs8099917 genotype GG is associated with HTLV-1-associated myelopathy/tropical spastic paraparesis (HAM/TSP) in HTLV-1 carriers. PLoS Negl Trop Dis. 2014;8(9):e3199.
16. Tanajura D, Castro N, Oliveira P, Neto A, Muniz A, Carvalho NB, et al. Neurological Manifestations in Human T-Cell Lymphotropic Virus Type 1 (HTLV-1)-Infected Individuals Without HTLV-1-Associated Myelopathy/Tropical Spastic Paraparesis: A Longitudinal Cohort Study. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2015;61(1):49-56.
17. Trevino A, Lopez M, Vispo E, Aguilera A, Ramos JM, Benito R, et al. Development of tropical spastic paraparesis in human T-lymphotropic virus type 1 carriers is influenced by interleukin 28B gene polymorphisms. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2012;55(1):e1-4.
18. Kamihira S, Usui T, Ichikawa T, Uno N, Morinaga Y, Mori S, et al. Paradoxical expression of IL-28B mRNA in peripheral blood in human T-cell leukemia virus type-1 mono-infection and co-infection with hepatitis C virus. Virology journal. 2012;9:40.
19. Vallinoto AC, Santana BB, Sa KS, Ferreira TC, Sousa RC, Azevedo VN, et al. HTLV-1-Associated Myelopathy/Tropical Spastic Paraparesis Is Not Associated with SNP rs12979860 of the IL-28B Gene. Mediators Inflamm. 2015;2015:804167.
20. Suppiah V, Moldovan M, Ahlenstiel G, Berg T, Weltman M, Abate ML, et al. IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy. Nature genetics. 2009;41(10):1100-4.
21. Tokura Y, Ito T, Kawakami C, Sugita K, Kasuya A, Tatsuno K, et al. Human T-lymphotropic virus 1 (HTLV-1)-associated lichenoid dermatitis induced by CD8+ T cells in HTLV-1 carrier, HTLV-1-associated myelopathy/tropical spastic paraparesis and adult T-cell leukemia/lymphoma. J Dermatol. 2015;42(10):967-74.
22. Ge D, Fellay J, Thompson AJ, Simon JS, Shianna KV, Urban TJ, et al. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance. Nature. 2009;461(7262):399-401.
23. Brites C, Sampalo J, Oliveira A. HIV/human T-cell lymphotropic virus coinfection revisited: impact on AIDS progression. AIDS reviews. 2009;11(1):8-16.
24. Machmach K, Abad-Molina C, Romero-Sanchez MC, Abad MA, Ferrando-Martinez S, Genebat M, et al. IL28B Single-Nucleotide Polymorphism rs12979860 Is Associated With Spontaneous HIV Control in White Subjects. The Journal of infectious diseases. 2013;207(4):651-5.
25. Jeffery KJ, Siddiqui AA, Bunce M, Lloyd AL, Vine AM, Witkover AD, et al. The influence of HLA class I alleles and heterozygosity on the outcome of human T cell lymphotropic virus type I infection. Journal of immunology. 2000;165(12):7278-84.
26. Poiesz BJ, Ruscetti FW, Gazdar AF, Bunn PA, Minna JD, Gallo RC. Detection and isolation of type C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma. Proceedings of the National Academy of Sciences of the United States of America. 1980;77(12):7415-9.
27. Kalyanaraman VS, Sarngadharan MG, Robert-Guroff M, Miyoshi I, Golde D, Gallo RC. A new subtype of human T-cell leukemia virus (HTLV-II) associated with a T-cell variant of hairy cell leukemia. Science. 1982;218(4572):571-3.
28. Ciminale V, Rende F, Bertazzoni U, Romanelli MG. HTLV-1 and HTLV-2: highly similar viruses with distinct oncogenic properties. Front Microbiol. 2014;5:398.
29. saúde Md. PORTARIA MS/SAS n. 163, de 3 DEZEMBRO DE 1993 In: SAÚDE SDAÀ, editor. Brasília: Diário Oficial; 1993.
30. Mortreux F, Gabet AS, Wattel E. Molecular and cellular aspects of HTLV-1 associated leukemogenesis in vivo. Leukemia : official journal of the Leukemia Society of America, Leukemia Research Fund, UK. 2003;17(1):26-38.
31. Edlich RF, Arnette JA, Williams FM. Global epidemic of human T-cell lymphotropic virus type-I (HTLV-I). The Journal of emergency medicine. 2000;18(1):109-19.
32. Galvao-Castro B, Loures L, Rodriques LG, Sereno A, Ferreira Junior OC, Franco LG, et al. Distribution of human T-lymphotropic virus type I among blood donors: a nationwide Brazilian study. Transfusion. 1997;37(2):242-3.
33. Casseb J, Fukumori L, Vergara M, Sanabani S, Marchiori P, Duarte A, et al. Lack of tax diversity for tropical spastic paraparesis/human T-cell lymphotropic virus type 1 (HTLV-I) associated myelopathy development in HTLV-I-infected subjects in Sao Paulo, Brazil. Memorias do Instituto Oswaldo Cruz. 2006;101(3):273-6.
34. Felber BK, Paskalis H, Kleinman-Ewing C, Wong-Staal F, Pavlakis GN. The pX protein of HTLV-I is a transcriptional activator of its long terminal repeats. Science. 1985;229(4714):675-9.
35. Llorens C, Futami R, Covelli L, Dominguez-Escriba L, Viu JM, Tamarit D, et al. The Gypsy Database (GyDB) of mobile genetic elements: release 2.0. Nucleic acids research. 2011;39(Database issue):D70-4.
36. Qu Z, Xiao G. Human T-cell lymphotropic virus: a model of NF-kappaB-associated tumorigenesis. Viruses. 2011;3(6):714-49.
37. Gessain A, Barin F, Vernant JC, Gout O, Maurs L, Calender A, et al. Antibodies to human T-lymphotropic virus type-I in patients with tropical spastic paraparesis. Lancet. 1985;2(8452):407-10.
38. Osame M, Usuku K, Izumo S, Ijichi N, Amitani H, Igata A, et al. HTLV-I associated myelopathy, a new clinical entity. Lancet. 1986;1(8488):1031-2.
39. Uchiyama T. Human T cell leukemia virus type I (HTLV-I) and human diseases. Annual review of immunology. 1997;15:15-37.
40. Assone T, Paiva A, Fonseca LA, Casseb J. Genetic Markers of the Host in Persons Living with HTLV-1, HIV and HCV Infections. Viruses. 2016;8(2).
41. Goncalves DU, Proietti FA, Barbosa-Stancioli EF, Martins ML, Ribas JG, Martins-Filho OA, et al. HTLV-1-associated myelopathy/tropical spastic paraparesis (HAM/TSP) inflammatory network. Inflamm Allergy Drug Targets. 2008;7(2):98-107.
42. Montanheiro PA, Penalva de Oliveira AC, Smid J, Fukumori LM, Olah I, da SDAJ, et al. The elevated interferon gamma production is an important immunological marker in HAM/TSP pathogenesis. Scandinavian journal of immunology. 2009;70(4):403-7.
43. Croda MG, de Oliveira AC, Vergara MP, Bonasser F, Smid J, Duarte AJ, et al. Corticosteroid therapy in TSP/HAM patients: the results from a 10 years open cohort. J Neurol Sci. 2008;269(1-2):133-7.
44. Montanheiro P, Vergara MP, Smid J, da Silva Duarte AJ, de Oliveira AC, Casseb J. High production of RANTES and MIP-1alpha in the tropical spastic paraparesis/HTLV-1-associated myelopathy (TSP/HAM). Journal of neuroimmunology. 2007;188(1-2):138-42.
45. Azimi N, Jacobson S, Leist T, Waldmann TA. Involvement of IL-15 in the pathogenesis of human T lymphotropic virus type I-associated myelopathy/tropical spastic paraparesis: implications for therapy with a monoclonal antibody directed to the IL-2/15R beta receptor. Journal of immunology. 1999;163(7):4064-72.
46. Verheyden S, Ferrone S, Mulder A, Claas FH, Schots R, De Moerloose B, et al. Role of the inhibitory KIR ligand HLA-Bw4 and HLA-C expression levels in the recognition of leukemic cells by Natural Killer cells. Cancer Immunol Immunother. 2009;58(6):855-65.
47. Singh P, Dass JF. A multifaceted computational report on the variants effect on KIR2DL3 and IFNL3 candidate gene in HCV clearance. Mol Biol Rep. 2016;43(10):1101-17.
48. Montes-Cano MA, Caro-Oleas JL, Romero-Gomez M, Diago M, Andrade R, Carmona I, et al. HLA-C and KIR genes in hepatitis C virus infection. Hum Immunol. 2005;66(11):1106-9.
49. Lunemann S, Martrus G, Holzemer A, Chapel A, Ziegler M, Korner C, et al. Sequence variations in HCV core-derived epitopes alter binding of KIR2DL3 to HLA-C *03:04 and modulate NK cell function. J Hepatol. 2016;65(2):252-8.
50. Cook LB, Elemans M, Rowan AG, Asquith B. HTLV-1: persistence and pathogenesis. Virology. 2013;435(1):131-40.
51. Seich Al Basatena NK, Macnamara A, Vine AM, Thio CL, Astemborski J, Usuku K, et al. KIR2DL2 enhances protective and detrimental HLA class I-mediated immunity in chronic viral infection. PLoS pathogens. 2011;7(10):e1002270.
52. Jeffery KJ, Usuku K, Hall SE, Matsumoto W, Taylor GP, Procter J, et al. HLA alleles determine human T-lymphotropic virus-I (HTLV-I) proviral load and the risk of HTLV-I-associated myelopathy. Proceedings of the National Academy of Sciences of the United States of America. 1999;96(7):3848-53.
53. Borducchi DM, Gerbase-DeLima M, Morgun A, Shulzhenko N, Pombo-de-Oliveira MS, Kerbauy J, et al. Human leucocyte antigen and human T-cell lymphotropic virus type 1 associated diseases in Brazil. Br J Haematol. 2003;123(5):954-5.
54. Catalan-Soares BC, Carneiro-Proietti AB, Da Fonseca FG, Correa-Oliveira R, Peralva-Lima D, Portela R, et al. HLA class I alleles in HTLV-1-associated myelopathy and asymptomatic carriers from the Brazilian cohort GIPH. Med Microbiol Immunol. 2009;198(1):1-3.
55. Deschamps R, Bera O, Belrose G, Lezin A, Bellance R, Signate A, et al. Absence of consistent association between human leukocyte antigen-I and -II alleles and human T-lymphotropic virus type 1 (HTLV-1)-associated myelopathy/tropical spastic paraparesis risk in an HTLV-1 French Afro-Caribbean population. Int J Infect Dis. 2010;14(11):e986-90.
56. Goedert JJ, Li HC, Gao XJ, Chatterjee N, Sonoda S, Biggar RJ, et al. Risk of human T-lymphotropic virus type I-associated diseases in Jamaica with common HLA types. Int J Cancer. 2007;121(5):1092-7.
57. Trevino A, Vicario JL, Lopez M, Parra P, Benito R, Ortiz de Lejarazu R, et al. Association between HLA alleles and HAM/TSP in individuals infected with HTLV-1. J Neurol. 2013;260(10):2551-5.
58. Sabouri AH, Saito M, Usuku K, Bajestan SN, Mahmoudi M, Forughipour M, et al. Differences in viral and host genetic risk factors for development of human T-cell lymphotropic virus type 1 (HTLV-1)-associated myelopathy/tropical spastic paraparesis between Iranian and Japanese HTLV-1-infected individuals. J Gen Virol. 2005;86(Pt 3):773-81.
59. Rafatpanah H, Pravica V, Faridhosseini R, Tabatabaei A, Ollier W, Poulton K, et al. Association between HLA-DRB1*01 and HLA-Cw*08 and outcome following HTLV-I infection. Iran J Immunol. 2007;4(2):94-100.
60. Bangham CR, Hall SE, Jeffery KJ, Vine AM, Witkover A, Nowak MA, et al. Genetic control and dynamics of the cellular immune response to the human T-cell leukaemia virus, HTLV-I. Philos Trans R Soc Lond B Biol Sci. 1999;354(1384):691-700.